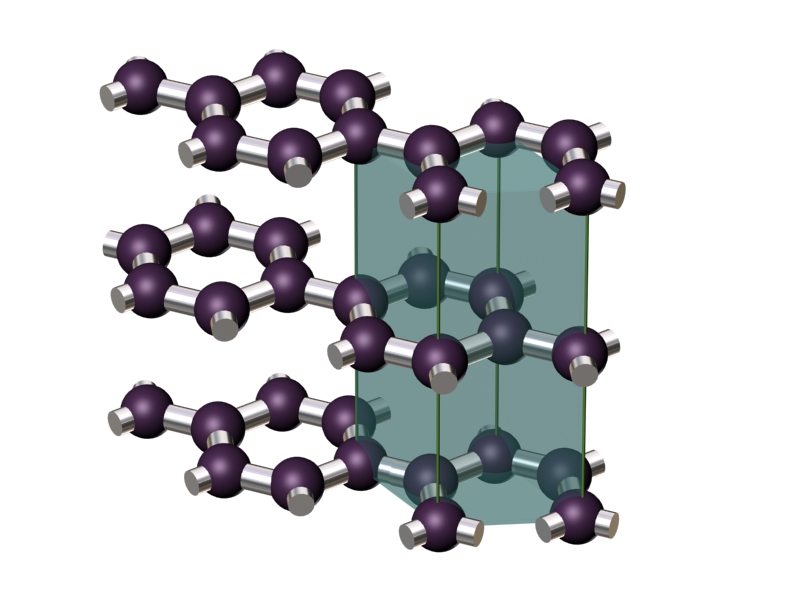
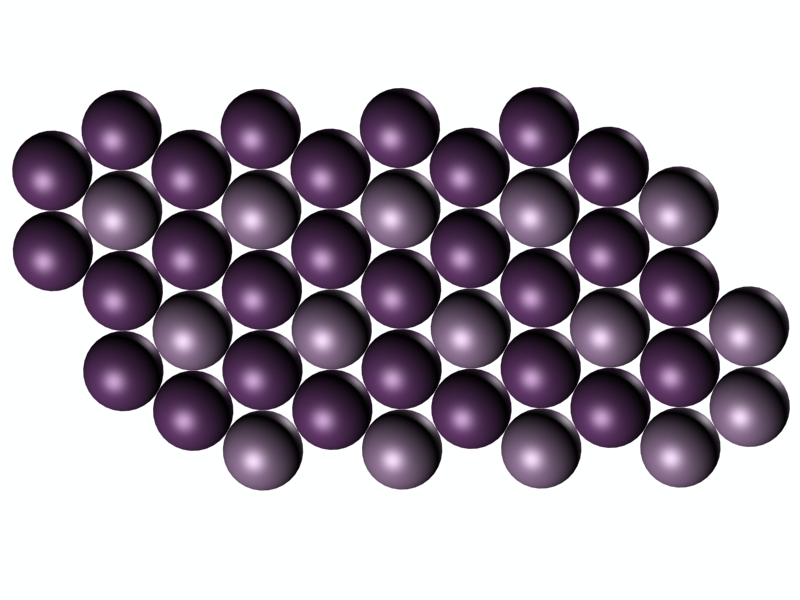
A diferencia del diamante, en el grafito los átomos de carbono forman anillos de seis lados, que se unen entre sí como si fuesen baldosas hexagonales, dando lugar a láminas planas. Cada una de estas láminas se denomina grafeno.
Cada átomo de carbono tiene entonces tres vecinos cercanos, dispuestos en ángulos de 120º, y con los que comparte un par de electrones con cada uno de ellos. El cuarto electrón de valencia de cada átomo se encuentra también enlazado, pero de forma más débil y no localizada, dando lugar a estructuras de enlaces resonantes. Son estos electrones deslocalizados los que permiten la conducción eléctrica a lo largo de una lámina, y los responsables del color negro, con brillo metálico, característico del grafito.
 |
 |
 |
Las distintas láminas se mantienen unidas entre sí por fuerzas de Van der Waals. Estas fuerzas de atracción son sólo ligeramente superiores a las fuerzas de cohesión de los líquidos, de lo que resulta que la distancia entre lámina y lámina sea más del doble de la distancia de enlace entre átomos de carbono en la lámina.