Trazador de diagramas de equilibrio binarios básicos
(Encontrará una descripción más amplia de este tema en la Adenda del Capítulo 10 del libro de “Ciencia e Ingeniería de los Materiales” de la Editorial Paraninfo. Dicha Adenda forma parte del material digital descargable desde la página de la editorial, en la pestaña de ‘Descarga previo registro’).
El cálculo teórico de un diagrama de fases binario consiste sencillamente en el trazado de sus líneas, tanto las que separan las zonas monofásicas de las bifásicas, como las que revelan eventuales puntos invariantes. Si se conoce previamente el tipo de diagrama y se dispone de la adecuada información termodinámica, es posible calcular sus líneas, de forma aproximada, mediante argumentos muy simples.
Diagramas del Tipo I
En estos sistemas aparece una región bifásica donde conviven una solución sólida sustitutiva, que denominaremos S, y una solución líquida L, ambas constituidas por los componentes A y B. La Fig. 1 muestra el diagrama de equilibrio calculado para el sistema Ni-Cu.
 |
| Figura 1 (a) Diagrama teórico Ni-Cu calculado a partir de los siguientes datos: TNi = 1728 K, TCu = 1351 K, = -17610 J/mol, = -13050 J/mol, M(Ni) = 58.71 g/mol, M(Cu) = 63.55 g/mol. (b) Diagrama experimental Ni-Cu. |
Diagramas del Tipo II
Para una aleación con insolubilidad total de sus componentes en estado sólido, existen dos regiones bifásicas entre líquido y sólido, en las que intervienen, por separado, los componentes puros. Un punto de gran interés en el cálculo es el que da la composición y temperatura del punto eutéctico.
En la Fig. 2 se muestra el resultado del cálculo del diagrama correspondiente al sistema Cd-Bi. Según estos cálculos, el eutéctico debería situarse en el 60.1% Bi y a la temperatura de 407.8 K. (Los datos experimentales también lo sitúan en torno al 60% Bi a 419 K.)
 |
| Figura 2 (a) Diagrama teórico Cd-Bi calculado a partir de los siguientes datos: TCd = 594 K, TBi = 544 K, = -6410 J/mol, = -10890 J/mol, M(Cd) = 112.41 g/mol, M(Bi) = 208.98 g/mol. (Nótese cómo ). (b) Diagrama experimental Cd-Bi. |
Diagramas del Tipo III
En el caso de que exista solubilidad parcial, de nuevo habrá dos líneas de líquidus en el diagrama, de cuya intersección podrá obtenerse el punto eutéctico. Habrán de calcularse también las dos ramas de la línea de sólidus, enlazadas por una horizontal a la temperatura eutéctica, y por último, las líneas de solvus correspondientes. Las fases que aparecen en el diagrama serán: el sólido Sa, formado principalmente por el componente A, pero con algo de B; el sólido Sb, que es predominantemente B, con algo de A; y el líquido L, que contiene tanto A como B. Como en el caso anterior, es crucial determinar la temperatura y puntos eutécticos, pero en este caso, además, es necesario encontrar, a esa temperatura, las solubilidades máximas de las fases sólidas.
En la Fig. 3 se muestra el diagrama calculado para el sistema Ag-Cu. Según estos cálculos, el eutéctico debería situarse en el 26.6%Cu (que difiere muy poco del valor experimentalmente medido que lo sitúa en el 28.8%).
 |
| Figura 3 (a) Diagrama teórico Ag-Cu calculado a partir de los siguientes datos: TAg = 1233.8 K, TCu = 1351 K, = -11090 J/mol, = -13050 J/mol, mAg = 18000 J/mol, mCu = 11800 J/mol, M(Ag) = 107.87 g/mol, M(Cu) = 63.55 g/mol. (b) Diagrama experimental Ag-Cu. |
Diagramas del Tipo IV
En el caso de que exista solubilidad parcial y aparezca una transformación peritéctica, las fases que aparecen en el diagrama serán, al igual que en los diagramas tipo III, el sólido Sa, el sólido Sb y el líquido L, que en todos los casos contienen tanto A como B, en distintas proporciones. Como en los casos anteriores, es vital determinar la temperatura y puntos de la transformación invariante (en este caso la peritéctica). Además, es necesario encontrar, a esa temperatura, las solubilidades máximas de las fases sólidas.
En la Fig. 4 se muestra el resultado del cálculo del diagrama correspondiente al sistema Re-Pt. Según estos cálculos, el eutéctico debería situarse en el 54.58% Pt, siendo el valor experimentalmente medido de 58% Pt.
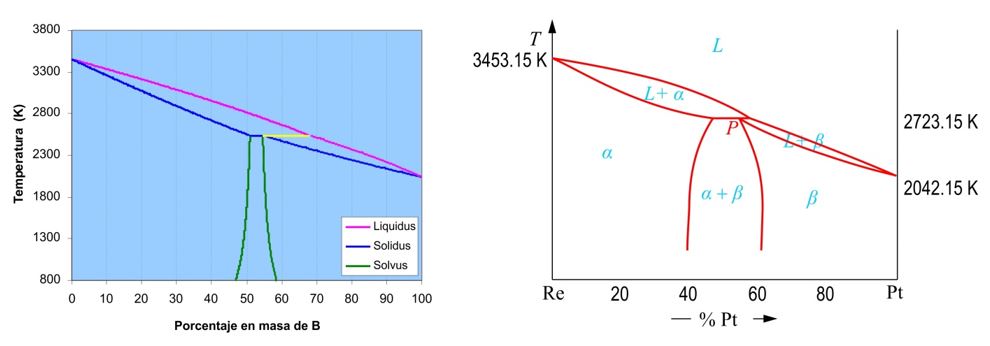 |
| Figura 4 (a) Diagrama teórico Re-Pt calculado a partir de los siguientes datos: TRe = 3453 K, TPt = 2042 K, = -33500 J/mol, = -19700 J/mol, mRe = 1600 J/mol, mPt = 1500 J/mol, M(Re) = 186.2 g/mol, M(Pt) = 195.09 g/mol. (b) Diagrama experimental del sistema Re-Pt. |
Que lo disfruten.
Parámetros
Resultados
Simulador
(versión web realizada por Gonzalo Jaime Coladas, a partir del código original en vb6 de J.M. Montes)

